Benutzer:BirgitLachner/Chemie-Buch I zum Lehrplan in Rheinland-Pfalz/Vom Erz zum Metall/Das Geheimnis der Kupfergewinnung und Oberstufen-Chemiebuch Kontextorientiert/Alltags-Kunststoffe - Kohlenstoff-Ketten in viele Variationen: Unterschied zwischen den Seiten
Markierung: 2017-Quelltext-Bearbeitung |
Markierung: 2017-Quelltext-Bearbeitung |
||
| Zeile 1: | Zeile 1: | ||
Nachdem wir uns auf der vorherigen Seite vor allem mit den Prinzipien der Kunststoffchemie beschäftigt haben, soll es nun um konkrete Typen von Kunststoffen gehen mit verschiedenen Monomeren und Polymeren. Dabei werden wir dann die Theorie nutzen, um die Eigenschaften der Stoffe erklären bzw. selber bestimmen können. | |||
Das | == Polyethylen == | ||
[[Datei:Polyethylene repeat unit.svg|right|100px]] | |||
Das Polyethylen (kurz PE) ist zwar nicht das erste Polymer, das hergestellt wurde, aber es ist das einfachste. Der Name '''Polyethylen''' ergibt sich aus dem Ausgangsstoff, dem Monomer, hier also das Ethylen = Ethen. Es ist deshalb das einfachste, da an der grundlegenden Struktur, die für eine Polymerisationsreaktion notwendig ist, also der Doppelbindung, keine weitere Kette oder Gruppe hängt. | |||
<center>[[File:RadicalPolymerization.png|600px]]</center> | |||
<center><gallery widths=" | <center><gallery widths="700" heights="350"> | ||
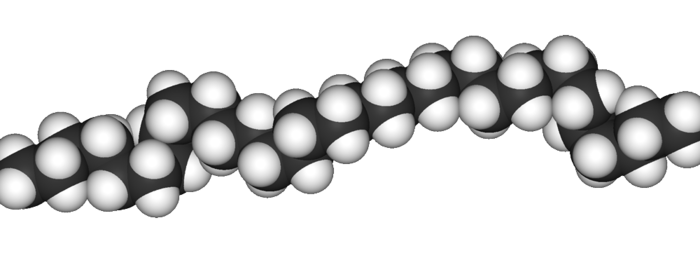
Datei:Polyethylene-3D-vdW.png|Eine einzelne Polyethylen-Kette, die Grundstruktur aller einfachen Kunststoffe. | |||
</gallery></center> | </gallery></center> | ||
Polyethylen ist mit einem Anteil von ca. 38 Prozent der weltweit am meisten genutzte Kunststoff. Die Anwendungen sind vielfältig: | |||
<center><gallery widths="350" heights="300"> | |||
File:LDPE bottle.jpg|Chemikalien-Flaschen die chemisch restistent sind | |||
File:Tengelmann-Tuete.jpg|Plastik-Tüten - leicht und recht reißfest | |||
File:Manille textile dyneema 03.jpg|Extra reißfeste Kletterseile | |||
File:Ziplock.jpg|Dünne, stabile und lebensmittelechte Plastik-Tüten | |||
</gallery></center> | |||
=== Geschichtliche Entwicklung === | |||
[[Datei:Diazomethane.svg|100px|right]] Zum ersten Mal wurde 1898 von dem deutschen Chemiker Hans von Pechmann zufällig hergestellt, als er mit Diazomethan (''siehe Bild'') experimentierte. Man erhielt eine weiße, wachsartige Substanz. Die Entstehung lässt sich recht leicht erklären, denn wenn vom instabilen Diazomethan ein Stickstoff-Molekül abgespalten wird, werden CH<sub>2</sub>-Gruppen frei, die sich zu einer langen Kette zusammensetzen können. Da Diazomethan sehr instabil ist, deswegen nicht in größeren Mengen gelagert werden kann und nebenbei auch giftig ist, ist die Herstellungsweise wenig erfolgreich gewesen. | |||
Die erste industrielle Polyethylen-Synthese wurde (''wieder durch Zufall'') 1933 in England von Chemikern entdeckt, die für die ICI (''Imperial Chemical Industries'') arbeiteten. Bei extrem hohen Drücken (''ca. 1400 bar'') erzeugten sie aus einem Gemisch aus Ethylen und Benzaldehyd ein weißes, wachsartiges Material. Das Benzaldehyd ist für die Reaktion nicht wirklich von Bedeutung und tatsächlich funktionierte die Methode nur wegen kleinen Mengen an Sauerstoff, die ins Reaktionsgefäß gelangt waren. Zwei Jahre später konnte dann aber wieder ein Chemiker von ICI eine tatsächlich funktionierende und nachvollziehbare Hochdrucksynthese für Polyethylen vorstellen. Sie war die Grundlage für die industrielle Produktion am 1939. | |||
Ein weiterer Meilenstein in der industriellen Herstellung von Polyethylen war die Entwicklung von Katalysatoren, die die Polymerisation bei milden Temperaturen und Drücken ermöglichen. Immer noch verwendet wird der 1953 nach seinen Entdeckern (''Karl Ziegler und Giulio Natta'') benannte '''Ziegler-Natta-Katalysator''', der '''Titanhalogeniden''' und aluminiumorganischen Verbindungen enthält. | |||
=== Verschiedene Typen von Polyethylen === | |||
Rein theoretisch ist eine solche Polymerisation ja eine eindeutige Sache: | |||
* mit einer '''Startreaktion''' wird eine Doppelbindung (''hier am Ethylen'') aufgespalten und damit die Kettenreaktion vorbereitet | |||
* in der '''Kettenreaktion''' bindet sich immer wieder eine C<sub>2</sub>H<sub>4</sub>-Gruppe nach der anderen, so dass die Kette länger und länger wird. | |||
Natürlich wird nicht nur an einer Stelle gestartet, aber wir gehen zunächst einmal davon aus, dass jede einzlene Kettenverlängerung für sich abläuft. Tatsächlich ist es so, das bei den ersten Polyethylen-Synthesen, aufgrund hohen Temperaturen gar keine so geordnete Polymerisation stattgefunden hat. Stattdessen kann man sagen, das die hohen Temperaturen an ganz vielen Stellen gleichzeitig die Doppelbindungen aufbrechen, dabei Radikale entstehen und so gleichzeitig viele Ketten anfangen zu wachsen. Diese radikalischen Ketten könnten sich dann beliebig mit anderen Ketten verbinden und durch Umlagerungen innerhalb des Ketten-Moleküls kann auch eine Seitenkette an einer längeren angehängt werden. Tatsache ist, dass die ersten Polyethlene sehr stark verzweigte Ketten bildeten, die man sich so vorstellen kann: | |||
<gallery widths="300" heights="200" | |||
<center>[[Datei:PE-LD schematic.svg|600px]]</center> | |||
{{Box|AUFGABE 1|Die ersten Polyethylene, die hergestellt wurden, waren eher klebrige, wachsartige Produkte und keinesfalls fest. | |||
* Was lässt sich damit über die allgemeinen physikalischen Eigenschaften des Polymers vermuten? | |||
|Üben | |||
}} | |||
Führt man stattdessen die Polymerisation bei niedrigen Temperaturen durch, wie es zum Beispiel beim '''Ziegler-Natta-Katalysator''' der Fall ist, so kann man den Verzweigungsgrad genau bestimmen. Für die Entdeckungen zur Nutzung von Katalysatoren bei der Polymerisation bekamen '''Karl Ziegler und Giulio Natta 1963 den Nobelpreis für Chemie'''. | |||
<center><gallery widths="300" heights="200"> | |||
Datei:Karl Ziegler Nobel.jpg|Karl Ziegler | |||
Datei:GDCh-Gedenktafel Karl Ziegler.jpg|Gedenktafel für Karl Ziegler in Mühlheim a.d. Ruhr | |||
File:Giulio Natta 1960s.jpg|Guilio Natta | |||
File:Complesso da laboratorio per produzione di polipropilene - Museo scienza tecnologia Milano 09714-D0974.jpg|Museum in Mailand, mit dem Experimenten von Natta | |||
</gallery></center> | |||
Statt der stark verzweigten Struktur, ist es mit dem Katalysator nun möglich, auch wenig bis gar nicht verzweigte Polyethylensorten zu gewinnen. | |||
<center> | |||
{| class="wikitable" | |||
|- | |||
| PE-HD oder HDPE || [[Datei:PE-HD schematic.svg|500px|Schematische Darstellung von PE-HD (Polyethylen hoher Dichte).]] | |||
|- | |||
| PE-LLD oder LLDPE || | |||
[[Datei:PE-LLD schematic.svg|500px|Schematische Darstellung von PE-LLD (lineares Polyethylen niedriger Dichte)]] | |||
|- | |||
| PE-LD oder LDPE|| [[Datei:PE-LD schematic.svg|500px|Schematische Darstellung von PE-LD (Polyethylen niedriger Dichte).]] | |||
|} | |||
</center> | |||
Die verschiedenen Kürzel, die hinter den Buchstaben PE stehen, beschreiben den wesentlichen Unterschied zwischen den drei Sorten, nämlich die unterschiedliche Dichte: | |||
* PE-HD hat einen hohe Dichte ('''H'''igh '''D'''ensity) von durchschnittlich etwa 0,955 g/cm<sup>3</sup> | |||
* PE-LD hat eine geringe Dichte ('''L'''ow '''D'''ensity) von durchschnittlich etwa 0,925 g/cm<sup>3</sup> | |||
* PE-LLD hat eine teilweise recht niedrige Dichte von 0,87–0,94 g/cm<sup>3</sup>, der Namen leitet sich von '''L'''inear '''L'''ow '''D'''ensity ab, da trotz der wenig verzweigten Struktur eine niedrige Dichte hat. | |||
{{Box|AUFGABE 2 | |||
|Schauen wir uns zur Wiederholung nach einmal den Begriff der Dichte an: | |||
* Wie ist die Dichte definiert? | |||
* Vergleicht man die Dichte von Stoffen im gasförmigen bzw. festen Zustand, so hat man gasförmigen Zustand eine sehr viel geringere Dichte? Wie lässt sich das erklären? | |||
* Wie kann man bei verschiedenen Feststoffen unterschiedliche Dichten erklären? | |||
|Üben | |||
}} | |||
Hier hat man einen direkten Zusammenhang zwischen innerer Struktur und der von außen zu messenden Eigenschaft, hier der Dichte. Dichte gibt ja an, wieviel Masse auf ein bestimmtes Volumen kommt. Da wir hier die gleichen Arten an Atomen (''nur C und H'') und eigentlich den gleichen Aufbau haben, geht es letztendlich hier um die Anzahl der Atome, die sich in einem Raumbereich befinden. Und die hängt von dem inneren Aufbau ab. Man kann sich das so vorstellen, dass bei unverzweigten Ketten, wie beim PE-HD, diese Ketten sehr nah aneinander und parallel anlagern können, da nichts absteht. Damit liegen viele Atome näher beieinander und damit ist mehr Masse im gleichen Raumbereich vorhanden. | |||
Beim PE-LD und PE-LLD ist der Abstand offensichtlich größer (also weniger Atome pro Raumbereich), was sich damit erklären lässt, dass die Seitenketten dazu führen, dass die Ketten ungeordnet neben- bzw. durcheinanderliegen. | |||
{{Box|AUFGABE 3|Interessanterweise die Dichte bei PE-LLD teilweise sogar niedriger als bei dem PE-LD. Das passt ja irgendwie gar nicht zu dem Aufbau der Kohlenstoffkette und der Menge an Verzweigungen. ''Spekuliere darüber, wie man das erklären könnte!'' | |||
|Üben}} | |||
=== Zusammenhang zwischen Struktur und Eigenschaften genauer betrachtet === | |||
==== Dichte ==== | |||
Wie auch die Dichte lassen sich weitere Eigenschaften der verschiedenen PE-Typen aufgrund des unterschiedlichen Molekülbaus erklären. Betrachten wir eine anderes andere Auswirkung, zu der wir bisher nur die Bezeichnung angesprochen haben. Dazu noch einmal kurz als Wiederholung: | |||
<center> | |||
<gallery widths="260" heights="260"> | |||
Datei:Polymerstruktur-linear.svg|Unverzweigte Ketten, die ungeordnet liegen = '''amorphe Struktur''' | |||
Datei:Polymerstruktur-verzweigt.svg|Teilweise verzweigte Ketten, die ungeordnet liegen = '''amorphe Struktur''' | |||
Datei:Polymerstruktur-teilkristallin.svg|Unverzweigte Ketten, die teilweise geordnet vorliegen = '''teilkristalline Struktur''', dazwischen Bereiche, in denen die Kette amorph vorliegt. | |||
</gallery> | </gallery> | ||
</center> | |||
{{Box|Teilkristalline Polymere|Bei '''Teilkristallinen Polymeren''' handelt es sich um thermoplastische Kunststoffe, in denen Bereiche existieren, bei denen sich die Polymerketten parallel anordnen konnten, was zu einer höheren Dichte führt. |Hervorhebung2}} | |||
Wie sich der unterschiedliche Molekülaufbau auf den Anteil an kristallinen Bereichen auswirkt kann man an der folgenden Tabelle auslesen. Dazu noch einmal die genauen Daten zur Dichte im Vergleich: | |||
<center> | |||
{| class="wikitable" | |||
|- | |||
! Eigenschaft !! PE-LD !! PE-HD !! PE-LLD | |||
|- | |||
| Dichte in g/cm<sup>3</sup> | |||
| 0,915–0,935 | |||
| 0,94–0,97 | |||
| 0,87–0,94 | |||
|- | |||
| Kristallinität in % | |||
| 40–50 | |||
| 60–80 | |||
| 10–50 | |||
|} | |||
</center> | |||
Kristalline Bereiche bedeuten ja, dass die Molekülketten parallel liegen und somit wenig Platz einnehmen und damit passen diese Daten gut zu der Dichte der verschiedenen Polyethylen-Typen. | |||
{{Box|Dichte bei Teilkristalline Polymere|Die Dichte ist bei '''teilkristallinen Polymeren''' meist höher als bei entsprechenden rein amorphen Polymeren, da in den teilkristalline Bereichen die Polymerketten eng beeinander liegen.|Hervorhebung1}} | |||
==== Schmelz- und Siedetemperatur ==== | |||
| | Betrachten wir nun mal die Schmelz- und Siedetemperatur der verschiedenen PE-Typen. Es sind ja allgemein zwei Dinge, die im Wesentlichen bei der Siedetemperatur eine Rolle dabei spielen: | ||
# '''Die Masse der Teilchen, die beim Erwärmen in Bewegung gebracht werden müssen.'''. Je größer die Masse der Teilchen ist, desto schwieriger ist es, sie in Bewegung zu bringen. Bei den Kunststoffen haben wir allgemein sehr große Moleküle (''bis zu mehreren tausend C-Atomen lange Ketten!''), so dass es hier vor allem darum geht, die Ketten in beim Schmelzen in Bewegung zu bringen. Diese langen Ketten führen auch dazu, dass die Kunststoffe meist fest sind. | |||
# '''Die Anziehung der Moleküle untereinander, die überwunden werden muss.''' Damit sich die Moleküle bewegen können, müssen auch die Anzeihungskräfte der Moleküle/Molekülketten untereinander überwunden werden. Da wir bei PE reine Kohlenwasserstoffketten haben, haben wir <u>keine</u> polaren Gruppierungen und daher wirken nur die Van-der-Waals-Kräfte. | |||
Die Molekular-Masse spielt nur dann eine Rolle, wenn sich die Anzahl der Atome in einer Polymer-Kette wesentlich unterschiedet. Bei festen Werkstoffen es weniger wichtig, denn die Unterschiede sind nicht so groß. Liegen die Ketten aber parallel (''wie in den teilkristallinen Bereichen''), so können die Van-der-Waals-Kräfte besser wirken. Die '''Van-der-Waals-Kräfte ''' bezeichnet ja die Anziehung durch sich zufällig ergebende Dipole, die bei günstiger Lage an Nachbarmoleküle weitergegeben werden können (''temporäre und induzierte Dipole''), wodurch kurzfristig eine Anziehung besteht. Die Anziehung ist umso höher, je größer die Fläche ist und je paralleler die Moleküle liegen. | |||
<center> | |||
<gallery widths="350" heights="250" style="text-align:center"> | |||
File:Forze di London.png|Verlagerte Elektronen in der Hülle der Atome führen zu kurzfrisitigen Dipolen. | |||
File:London Forces in alkanes.png|Vergleich gerader und verzweigter Alkane und die Möglichkeit für Van-der-Waals-Kräfte. | |||
</gallery></center> | |||
Wenn die Anziehung bei parallelen Ketten größer ist, sollte auch die Siedetemperatur mit höherer Kristallität größer sein. Hier dazu die Daten, die das belegen: | |||
<center> | |||
{| class="wikitable" | |||
|- | |||
! Eigenschaft !! PE-LD !! PE-HD !! PE-LLD | |||
|- | |||
| Kristallinität in % | |||
| 40–50 | |||
| 60–80 | |||
| 10–50 | |||
|- | |||
| Schmelzpunkt in °C | |||
| 130–145 | |||
| 130–145 | |||
| 45–125 | |||
|- | |||
| Wärmeformbeständigkeit bis °C | |||
| 80 | |||
| 100 | |||
| 30–90 | |||
|} | |||
</center> | |||
Offensichtlich passt der Zusammenhang bei dem PE-LLD sehr gut, denn es hat die niedrigste Siedetemperatur bei dem geringsten Anteil an Kristallinität. Das PE-LD zeigt, ähnlich wie bei der Dichte, dass es da Auswirkungen durch die langen und auch verzweigten Seitenketten gibt, die die Anziehung wiederum verbessern, so dass wir bei PE-HD und PE-LD den gleichen Schmelzbereich haben. | |||
Unterschiede gibt es bei der Wärmeformbeständigkeit, einer speziellen Messgröße zur Untersuchung von Kunststoffen. | |||
{{Box| | {{Box|HINWEIS: Wärmeformbeständigkeit|Die '''Wärmeformbeständigkeit''' ist ein Maß für die Temperaturbelastbarkeit von Kunststoffen. Dabei wird zum Beispiel die Temperatur bestimmt, bei der sich eine Probe verbiegen lässt und ein Prüfkörper in das Material andringt.|Hervorhebung1}} | ||
Allerdings bleibt das PE-HD länger stabil und ist erst bei einer höheren Temperatur verformbar. | |||
Das | ==== Härte und Reißfestigkeit ==== | ||
Das folgende Bild zeigt einen Überblick, wie Molekülmasse und Kristallinität sich auf die Eigenschaften der Polyethylene als Feststoff auswirken. Neben den der Schmelztemperatur gibt es da noch Unterschiede bezüglich der Festigkeit (hart, weich, spröde). | |||
<center>[[Datei:Polyethene molar mass cristallinity.svg]]</center> | |||
Die Darstellunng macht deutlich, dass man harte Kunststoffe nur bekommt, wenn es einen hohen Zusammenhalt zwischen verschiedenen Molekülketten gibt. Das kann entweder durch Kristalline Bereiche geschehen oder, was wir bisher nur theoretischen angesprochen haben, bei den Duroplasten, wo man echte Bindungen zwischen den Molekülketten haben muss. | |||
Überlegen wir uns, ob der wir die verschiedenen Eigenschaften von den verschiedenen PE-Varianten erklären können. | |||
''' | {{Box|HINWEIS: Wachs|''Ein Stoff wird als '''Wachs''' bezeichnet, wenn er bei 20 °C knetbar, fest bis brüchig-hart ist, eine grobe bis feinkristalline Struktur aufweist, über 40 °C ohne Zersetzung schmilzt, wenig oberhalb des Schmelzpunktes dünnflüssig ist.''|Hervorhebung1}} | ||
{{Box|Das Diagramm verstehen|2=Das Besondere an diesem Diagramm ist, dass wir hier nicht eine funktionelle Zuordnung haben, wie sonst bei Graphen. Man darf das Diagramm also nicht so verstehen, dass man fragt: Welche Kristallinität gehört zu welchem Molekulargewicht. Vielmehr ist jede Art von Kombination an Molekulargewichtung und Kristallinität möglich und das Diagramm zeigt an, welche nach außen sichtbaren Eigenschaften der entstandene Kunststoff dann hätte. | |||
<div class="mw-collapsible mw-collapsed" data-expandtext="Vergleich mit p-T-Phasendiagramm von Wasser anzeigen" data-collapsetext="Vergleich mit p-T-Phasendiagramm von Wasser verbergen"> | |||
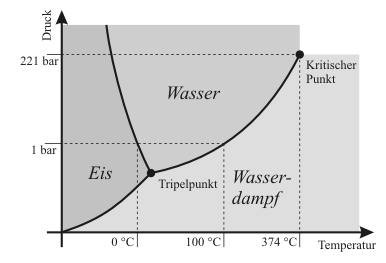
[[Datei:Phasendiagramm Wasser.png|right|500px]]Man kann das Diagramm eher mit dem p-T-Zustandsdiagrammen vergleichen wie sie zum Beispiel von Wasser beschreiben, welchen Aggregatzustand Wasser bei einer bestimmten Temperatur hat. | |||
So kann man als zu einem bestimmten Druck und einer bestimmten Temperatur ablesen, welchen Aggregatzustand das Wasser bei diesen Bedingungen hat.</div> | |||
|3=Hervorhebung1}} | |||
{{Box|AUFGABE 5 - Wähle die richtigen Bedingungen!|[[File:Tupperdose.jpg|right|150px]] | |||
Tupperware macht Werbung für ihre besonders haltbaren und auch bei kalten Temperaturen nicht spröde werdenden Dosen. Bei Normaltemperatur sind die Dosen dagegen recht weich und geben beim Anfassen ein geradzu wachsartiges Gefühl. Welche Art von Polyethylen könnten die Entwicklungsingenieure für die Gefrierdosen verwendet haben? | |||
* Gib an, wie die Molekularmasse und der Kristallisationsgrad sein müsste.|Üben}} | |||
{{Box|AUFGABE | {{Box|AUFGABE 6 - Auswirkungen von Molekulargewicht und Kristallinität| | ||
Versuche allgemein zu beschreiben, wie sich die Eigenschaften eines Polyethylens generell mit | |||
* größer werdendem Molekulargewicht | |||
* | * mit zunehmender Kristallinität | ||
verändern. Betrachte dazu die Tendenz jeweils in einer Achsenrichtung getrennt von der anderen Achsenrichtung. | |||
|Üben}} | |Üben}} | ||
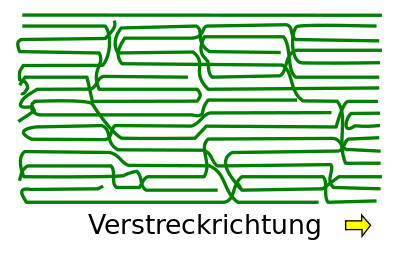
Um die Stabilität eines Kunststoffes zu verbessern, gibt es ein spezielles Verfahren, durch das man in dem Material den Anteil der kristallinen Bereiche erhöhen kann. Dies geschieht beim sogenannten '''Verstrecken'''. Es führt zu einer erhöhten Orientierung der Kettenmoleküle, sprich sie ordnen sich parallel zueinaner an, was die Entstehung von kristallinen Bereichen bedeutet und damit eine höhere Stabilität. Gerade bei Fasern, wird dieses Verfahren häufig genutzt. | |||
[[File:Kristallisation durch Verstreckung (Polymer).svg|400px]] | |||
==== Chemische Beständigkeit ==== | |||
Zwei Aspekte spielen bei der Chemikalienbeständigkeit eine Rolle: | |||
* Wie reaktiv sind die Atome/Gruppierungen innerhalb des Makromoleküls. | |||
* Wie dicht die nebeneinander liegende Makromoleküle zueinander liegen. | |||
Da alle Polyethylen-Typen aus den gleichen Arten von Atomen bestehen, gibt es hier keinen Unterschied. Die Moleküle sind alle nach außen hin unpolar, wie es bei allen Alkanen ist, egal ob die Moleküle verzweigt sind oder linear. | |||
Gäbe es funktionelle Gruppen oder andere Atome, so würde das zu Teilladungen führen, die eine Angriffsmöglichkeit für polare Lösungsmittel bieten würde. So sind alle Polyethylen-Arten beständig gegen schwache Säuren und Laugen und sie quellen Wasser nicht auf. Die Gas- und Wasserdampfdurchlässigkeit (von polaren Stoffen) ist niedriger als bei den meisten Kunststoffen. Unploare Gase wie Sauerstoff und Kohlendioxid diffundiert allerdings durch PE hindurch. | |||
Schauen wir uns eine Vergleich der chemischen Beständigkeit bei den verschiedenen PE-Typen genauer in einer Tabelle an: | |||
{ | {| class="wikitable" | ||
|- class="hintergrundfarbe6" | |||
! Eigenschaft !! PE-LD !! PE-HD !! PE-LLD | |||
|- | |||
| Chemische Beständigkeit || bedingt beständig|| beständig, außer starke Oxidationsmittel || bedingt beständig | |||
|- | |||
|beständig gegen ... ||Wasser, verdünnte Säuren, Laugen, Salzlösungen, Lösungsmittel, Alkohole, aliphatische Kohlenwasserstoffe, Benzin || Heißwasser, Mineralsäuren, Laugen, Lösungen anorganischer Salze, aliphatische Kohlenwasserstoffe, Alkohole, Ester, Ketone, Mineralöle, Amine, organische Säuren, Fette und Öle. || Wasser, verdünnte Säuren, Laugen, Salzlösungen, Lösungsmittel, Alkohole, aliphatische Kohlenwasserstoffe, Benzin | |||
|- | |||
|unbeständig gegen ... ||starke Säuren und Oxidationsmittel, oxidierende Säuren, Ester, Ketone, aromatische und chlorierte Kohlenwasserstoffe || oxidierende Säuren, aromatische Kohlenwasserstoffe || starke Säuren und Oxidationsmittel, oxidierende Säuren, Ester, Ketone, aromatische und chlorierte Kohlenwasserstoffe | |||
|} | |||
Insgesamt kann man sagen, dass | |||
{{Box|AUFGABE 7|Vervollständige den Multpile-Choice-Test zu chemischen Beständigkeit: | |||
}} | |||
==== Einsatzmöglichkeiten für die verschiedenen PE-Typen ==== | |||
Die | Die unterschiedlichen Eigenschaften der verscheidenen PE-Typen führt zu ganz verschiedenen Anwendungsgebieten. | ||
Da '''PE-HD''' mit seinem höheren Anteil an kristallinen Bereichen wesentlich stabiler ist, wird es meist für Formteile verwendet. Dazu gehören Haushaltswaren, Lager- und Transportbehälter, Abfalltonnen, Flaschenkästen, Benzinkanister und Kraftfahrzeugtanks. Aber auch Seile können daraus hergestellt werden. | |||
'''PE-LD''' und '''PE-LLD''' werden dagegen eher zu Folien für die Verpackaung oder als Beschichtung für andere Materialien verwendet: Schwersack-Folien, Schrumpffolien, Tragetaschen, Landwirtschaftsfolien, Wasserdampfsperren bei Verbundmaterialien, Ummantelungen von Fernmeldekabeln, Beschichtung von Stahlrohren, flexible Behälter und Flaschen. | |||
In der Verarbeitung unterscheiden sich die alle PE-Typen nur unwesentlichen. Als Thermoplast kann PE in verflüssigter Form in Formen gegossen und in aufgeblasen werden. Unterschiedlich ist nur die Verarbeitungstemperatur. Einen Einfluss auf die Kristallinität hat aber auch die Geschwindigkeit, mit der das Material abgekühlt wird. Schnell abgekühlte Formteile weisen eine geringe Kristallinität auf, da die Moleküle keine Zeit hatten sich parallel anzuordnen. | |||
{{Box|AUFGABE|2=Versuch in diesem Multiple-Choice Test noch einmal zu wederholen, warum diese|3=Üben}} | |||
=== Recycling von Polyethylen === | |||
''' | <div class="grid"> | ||
<div class="width-1-2"> | |||
''Ein Strand am Roten Meer in Ägypten'' [[Datei:Beach in Sharm el-Naga03.jpg]] | |||
</div> | |||
<div class="width-1-2"> | |||
[[Datei:Plastic-recyc-04.svg|right|150px]] Schon bei Polyethylen, den am häufigsten hergestellten Kunststoff, stellt sich die Frage, ob die Mengen an verwendeten Pastikverpackungen nicht zu viel ist. | |||
''' | Ähnlich wie bei anderen Kunststoffe geht man davon aus, dass auch Polyethylen sich erst nach bis zu 450 Jahre von alleine zersetzt (→ [https://www.umweltbundesamt.de/sites/default/files/medien/419/dokumente/wie_lange_braucht_der_muell_um_abgebaut_zu_werden.pdf ''andere Müllarten zum Vergleich'']). Seine chemische und biologische "Stabilität", was Kunststoffe als Werkstoffe so praktisch machen, führen aktuell zu immer mehr Umweltverschumtzung. | ||
Da es sich bei Polyethylen um einen Thermoplasten handelt ist es theoretisch recht gut wiederzu verwerten, denn man kann es theoretisch einfach umschmelzen zu einem neuen Produkt. In Deutschland gibt es ein recht gut ausgebautes Recycling-System, das im Wesentlichen aus dem Rücknahme-System "Grüner Punkt" entstanden ist. | |||
{{Box|[https://www.umweltbundesamt.de/themen/abfall-ressourcen/produktverantwortung-in-der-abfallwirtschaft/kunststoffe Umweltbundesamt - Kunststoff-Recycling] |''2013 fielen in Deutschland 5,68 Millionen Tonnen Kunststoffabfälle an. Der überwiegende Teil sind Produktabfälle, die beim privaten Endverbraucher oder im Gewerbe anfallen: etwa 4,75 Millionen Tonnen. Der Rest sind Produktions- und Verarbeitungsabfälle: 0,93 Millionen Tonnen. Die meisten Kunststoffabfälle stammen aus dem Verpackungsbereich: 1,4 Millionen Tonnen. <\br> | |||
...<\br> | |||
Die anfallenden Kunststoffe werden nahezu vollständig verwertet (in 2013 zu 99 Prozent).''|Zitat}} | |||
</div> | </div> | ||
</div> | |||
{{Box|VORTRAG Arten des Recycling|Informiere dich über mögliche Arten von Recycling. Du musst dich dabei nicht auf Polyethylen und Thermoplaste beschränken.|Üben}} | |||
Während man in Deutschland also einigermaßen auf das Recycling achtet, ist das gerade in vielen Entwicklungsländern ein eklatantes Problem. Gerade im Meer sammeln sich in einigen Gegenden aufgrund besonderer Strömungen Unmengen an Müll, der durch die mechanische Bearbeitung von Wind und Wellen zu Mikroplastik-Teilch zerfallen. | |||
Die Bedeutung von Plastik-Müll im Meer wurde anfangs erst einmal verharmlost. In den 1980er Jahren gingen Wissenschaftler noch davon aus, dass die Plastikteilchen nicht weiter gefährlich für die Umwelt seien, da sie von Algen und Kleinstlebewesen besiedelt wurden. | |||
2012 berichtete das wissenschaftliche Fachjournal ''Environmental Science & Technology'' aber über eine Untersuchung an vielen Stränden auf allen sechs Kontinenten, die überall Mikroplastikteilchen nachwies; dazu gehören wohl auch Fasern aus Fleece- und anderen Kleidungsstücken aus synthetischen Materialien: Beim Waschen in der Waschmaschine enstehen bis zu 1900 kleinste Kunststoffteilchen pro Waschgang, die durch die Bewegung in der Waschtrommel abbrechen. | |||
Trotz ihrer geringen Größe sind Mikropartikel vermutlich das größte Problem, denn über Meeres-Tiere, die sich normalerweise von Kleinstlebewesen ernähren, können sie auch in Lebensmittel gelangen und damit womöglich auf unseren Tisch. Problematisch sind sie auch deshalb, weil sie im Gegensatz zu größeren Gegenständen nicht so einfach aus dem Meer gefischt werden können. | |||
<gallery heights="300" widths="300"> | |||
Datei:Albatross at Midway Atoll Refuge (8080507529).jpg|Mageninhalt eines verendeten Albatrosses. | |||
Datei:Turtle entangled in marine debris (ghost net).jpg|Schildkröte, die von einem Geisternetz stranguliert wird. | |||
</gallery> | |||
{{Box|VORTRAG Aktuelle Informationen zur Verschmutzung des Meeres durch Platik-Müll|Informiere dich die Entwicklung und die aktuelle Situation.|Üben}} | |||
{{Box|VORTRAG Verbot von PlastikTüten in Afrika|Einige Länder Afrikas haben Ende2017/Anfang 2018 strenge Gesetze zur Vermeidung der Flut an Plastik-Müll und seinen verheerenden Umweltfolgen erlassen. In Kenia drohen Herstellern, Verkäufern und sogar Benutzern von Plastiktüten Haftstrafen von bis zu vier Jahren oder Geldbußen von 40.000 Dollar, umgerechnet etwa 32.000 Euro. | |||
* Informiere dich über die aktuelle Situation in Kenia, wie die Regierung das Gesetz durchetzen will und welche Chancen ein solches Verbot bietet.|Üben}} | |||
{{Box|AUFGABE XX|Warum ein echtes Recycling sich immer noch nicht wirklich lohnt, wird in diesem Artikel vom WDR erläutert: [https://www1.wdr.de/wissen/technik/kunststoffmuell-recycling-100.html Kunststoff-Recycling noch zu teuer]. | |||
* Fasse die Informationen des Textes zusammen. | |||
|Üben}} | |||
=== Abschluss === | |||
Obwohl wir uns hier nur mit einer Art Kunststoff beschäftigt haben, zeigt sich schon hier, das durch die Wahl eines Produktionsverfahren, Produktionsbedingungen, Katalysatoren usw. gezielt Polymere mit erwünschten Eigenschaften hergestellt werden können. Und neben harten oder weichen Kunststoffen sind auch Wachse, Fette und sogar Öle aus Polyethylen herstellbar. | |||
Was wir beim Polyethylen schon erkannt haben, werden wir auch bei den folgenden Kunststoffe anwenden ... und noch ein wenig mehr kennenzulernen. | |||
== Polypropylen (PP) == | |||
=== Synthese von Polypropylen === | |||
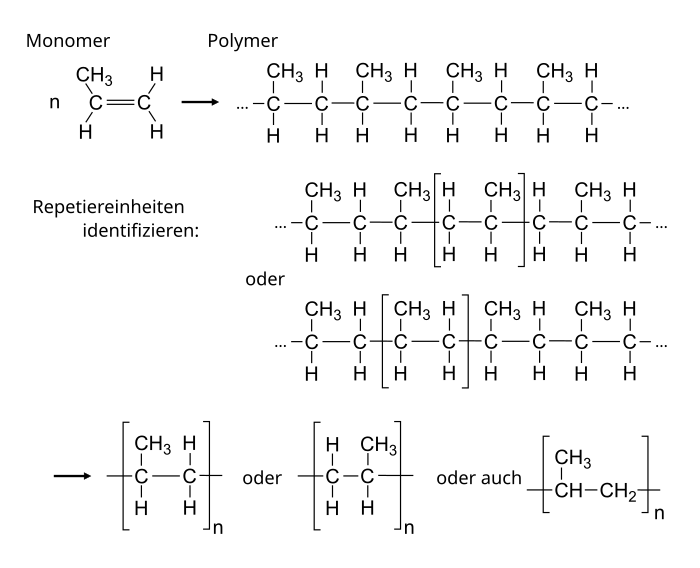
Zu Beginn noch einmal die Wiederholung der grundlegenden Begriffe: | |||
[[Datei:Zusammenhang Monomer Polymer und Repetiereinheit beim Polypropylen.svg|zentriert|700x700px]] | |||
Polypropylen '''PP''' ist neben dem am häufigsten verwendeten Poylethylen der am zweithäufigsten verwendete Standardkunststoff und wird häufig in Verpackungen verwendet. Hier einige Beispiele für die Nutzung von PP | |||
<gallery widths="200" heights="400" style="text-align:center"> | |||
Datei:Plastic 2000ml beaker.jpg|Kunststoffbecher für die Laborbenutzung | |||
Datei:Mint box polypropylene lid.JPG|Deckel der TicTac-Packung | |||
Datei:PP-Becher.jpg|Transparente Verpackungs-Behälter | |||
</gallery> | |||
Im Gegensatz zum Polyethylen, haben wir beim Polypropylen eine Seitenkette. Selbst wenn die Monomere sich immer auf die gleiche Art und Weise anordnen, kann die räumliche Anordnung der Methylgruppe unterschiedlich sein. Dabei unterscheidet man zwischen drei Varianten . | |||
{{Box|Taktizität beim Polyethylen|2= | |||
<div class="grid"> | |||
<div class="width-1-2">[[File:Animation Polyethylen isotaktisch.gif]]</div> | |||
<div class="width-1-2">'''isotaktisch''' bei einem Polymer dessen Reste in eine Richtung zeigen bzw. räumlich identisch gebunden sind</div> | |||
</div> | |||
<div class="grid"> | |||
<div class="width-1-2"> | |||
[[File:Animation Polyethylen syndiotaktisch.gif]] | |||
</div> | |||
<div class="width-1-2">'''syndiotaktisch''' wenn die Reste abwechselnd an der Hauptkette in die zwei möglichen Rchtungen zeigen bzw. räumlich gebunden sind | |||
<small>''Die zwei Bilder zeigen die Polypropylen-Kette einmal von der Seite und einmal von oben!''</small> | |||
</div> | |||
</div> | |||
<div class="grid"> | |||
<div class="width-1-2"> | |||
[[File:Animation Polyethylen ataktisch.gif]] | |||
</div> | </div> | ||
<div class="width-1-2">'''aktaktisch''', bei einer zufälligen räumlichen Anordnung der Reste.</div> | |||
</div> | |||
|3=Hervorhebung1}} | |||
{{Box|Taktizität der Seitenketten → {{wpde|Taktizität}}|2= | |||
Die '''Taktizität''' (griech. ''taxis'' „Anordnung“), auch '''Stereoregularität''', beschreibt die in bestimmten Intervallen wiederkehrende Anordnung von Seitenketten in einem Polymer. Prinzipiell kann Taktizität nur bei Polymeren auftreten, die aus asymmetrischen Monomeren aufgebaut sind, so z. B. bei Polypropylen oder Polystyrol, jedoch nicht bei Polyethylen oder Polytetrafluorethylen. | |||
|3=Zitat}} | |||
{{Box|AUFGABE XX - Eigenschaften von verschiedenen PP-Typen |2= | |||
* Überlege bei den verschiedenen Polypropylenarten, wie sich die Taktizität auf die Kristallinität auswirkt! | |||
* Wie wirkt sich wiederrum die Kristallinität auf weitere Eigenschaften wie die Schmelztemperatur aus? | |||
<div class="mw-collapsible mw-collapsed" data-expandtext="Lösung anzeigen" data-collapsetext="Lösung verbergen"> | |||
{{Box|Lösung PP-Typen und ihre Eigenschaften |2= | |||
'''Begriffe:''' Kristallinität (amorph oder teilkristallin) und die thermischen Eigenschaften (Glasübergangspunkt T<sub>g</sub> (''= Glasübergangstemperatur = Temperatur unter der der Kunststoff eher spröde ist'') und T<sub>m</sub> (''= Schmelztemperatur'') | |||
[[Datei:Polypropylene tacticity de.svg|600px]] | |||
|3=Lösung}}</div>|3=Üben}} | |||
===Vergleich der Eigenschaften von PE und PP=== | |||
* Polypropylen ähnelt in vielen Eigenschaften Polyethylen, speziell im Lösungsverhalten und den elektrischen Eigenschaften. | |||
* Die zusätzlich vorhandene Methylgruppe verbessert die mechanischen Eigenschaften und die thermische Beständigkeit, während die chemische Beständigkeit durch sie sinkt. | |||
* Durch das tertiäre Kohlenstoffatom ist PP chemisch weniger beständig als PE. | |||
* PP ist geruchlos und hautverträglich, für Anwendungen im Lebensmittelbereich und der Pharmazie ist es geeignet, es ist physiologisch unbedenklich und biologisch inert. | |||
* PP kann mit mineralischen Füllstoffen wie z. B. Talkum, Kreide oder Glasfasern gefüllt werden. Dadurch wird das Spektrum der mechanischen Eigenschaften (Steifigkeit, Gebrauchstemperaturen, etc.) deutlich erweitert. | |||
* | |||
=== Transparenz von PP === | |||
== Polyvinylchlorid (PVC) == | |||
== Polystyrol (PS) == | |||
Besser bekannt in geschäumtem Zustand als Styropor® (Handelsname der BASF) | |||
== Polytetrafluorethylen (PTFE) == | |||
Sein Handelsname ist Teflon® (E. l. Du Pont de Nemours and Company) oder Tefal® | |||
== Polymethylmethacrylat (PMMA) == | |||
Unter dem Handelsnamen Plexiglas® (Evonik Industries AG) verkauft. | |||
== Polyacrylnitril (PAN) == | |||
, als Copolymer mit Polymethylmethacrylat zur Herstellung von Textilfasern | |||
Version vom 18. Februar 2018, 13:13 Uhr
Nachdem wir uns auf der vorherigen Seite vor allem mit den Prinzipien der Kunststoffchemie beschäftigt haben, soll es nun um konkrete Typen von Kunststoffen gehen mit verschiedenen Monomeren und Polymeren. Dabei werden wir dann die Theorie nutzen, um die Eigenschaften der Stoffe erklären bzw. selber bestimmen können.
Polyethylen
Das Polyethylen (kurz PE) ist zwar nicht das erste Polymer, das hergestellt wurde, aber es ist das einfachste. Der Name Polyethylen ergibt sich aus dem Ausgangsstoff, dem Monomer, hier also das Ethylen = Ethen. Es ist deshalb das einfachste, da an der grundlegenden Struktur, die für eine Polymerisationsreaktion notwendig ist, also der Doppelbindung, keine weitere Kette oder Gruppe hängt.
Polyethylen ist mit einem Anteil von ca. 38 Prozent der weltweit am meisten genutzte Kunststoff. Die Anwendungen sind vielfältig:
Geschichtliche Entwicklung
Zum ersten Mal wurde 1898 von dem deutschen Chemiker Hans von Pechmann zufällig hergestellt, als er mit Diazomethan (siehe Bild) experimentierte. Man erhielt eine weiße, wachsartige Substanz. Die Entstehung lässt sich recht leicht erklären, denn wenn vom instabilen Diazomethan ein Stickstoff-Molekül abgespalten wird, werden CH2-Gruppen frei, die sich zu einer langen Kette zusammensetzen können. Da Diazomethan sehr instabil ist, deswegen nicht in größeren Mengen gelagert werden kann und nebenbei auch giftig ist, ist die Herstellungsweise wenig erfolgreich gewesen.
Die erste industrielle Polyethylen-Synthese wurde (wieder durch Zufall) 1933 in England von Chemikern entdeckt, die für die ICI (Imperial Chemical Industries) arbeiteten. Bei extrem hohen Drücken (ca. 1400 bar) erzeugten sie aus einem Gemisch aus Ethylen und Benzaldehyd ein weißes, wachsartiges Material. Das Benzaldehyd ist für die Reaktion nicht wirklich von Bedeutung und tatsächlich funktionierte die Methode nur wegen kleinen Mengen an Sauerstoff, die ins Reaktionsgefäß gelangt waren. Zwei Jahre später konnte dann aber wieder ein Chemiker von ICI eine tatsächlich funktionierende und nachvollziehbare Hochdrucksynthese für Polyethylen vorstellen. Sie war die Grundlage für die industrielle Produktion am 1939.
Ein weiterer Meilenstein in der industriellen Herstellung von Polyethylen war die Entwicklung von Katalysatoren, die die Polymerisation bei milden Temperaturen und Drücken ermöglichen. Immer noch verwendet wird der 1953 nach seinen Entdeckern (Karl Ziegler und Giulio Natta) benannte Ziegler-Natta-Katalysator, der Titanhalogeniden und aluminiumorganischen Verbindungen enthält.
Verschiedene Typen von Polyethylen
Rein theoretisch ist eine solche Polymerisation ja eine eindeutige Sache:
- mit einer Startreaktion wird eine Doppelbindung (hier am Ethylen) aufgespalten und damit die Kettenreaktion vorbereitet
- in der Kettenreaktion bindet sich immer wieder eine C2H4-Gruppe nach der anderen, so dass die Kette länger und länger wird.
Natürlich wird nicht nur an einer Stelle gestartet, aber wir gehen zunächst einmal davon aus, dass jede einzlene Kettenverlängerung für sich abläuft. Tatsächlich ist es so, das bei den ersten Polyethylen-Synthesen, aufgrund hohen Temperaturen gar keine so geordnete Polymerisation stattgefunden hat. Stattdessen kann man sagen, das die hohen Temperaturen an ganz vielen Stellen gleichzeitig die Doppelbindungen aufbrechen, dabei Radikale entstehen und so gleichzeitig viele Ketten anfangen zu wachsen. Diese radikalischen Ketten könnten sich dann beliebig mit anderen Ketten verbinden und durch Umlagerungen innerhalb des Ketten-Moleküls kann auch eine Seitenkette an einer längeren angehängt werden. Tatsache ist, dass die ersten Polyethlene sehr stark verzweigte Ketten bildeten, die man sich so vorstellen kann:
Die ersten Polyethylene, die hergestellt wurden, waren eher klebrige, wachsartige Produkte und keinesfalls fest.
- Was lässt sich damit über die allgemeinen physikalischen Eigenschaften des Polymers vermuten?
Führt man stattdessen die Polymerisation bei niedrigen Temperaturen durch, wie es zum Beispiel beim Ziegler-Natta-Katalysator der Fall ist, so kann man den Verzweigungsgrad genau bestimmen. Für die Entdeckungen zur Nutzung von Katalysatoren bei der Polymerisation bekamen Karl Ziegler und Giulio Natta 1963 den Nobelpreis für Chemie.
Statt der stark verzweigten Struktur, ist es mit dem Katalysator nun möglich, auch wenig bis gar nicht verzweigte Polyethylensorten zu gewinnen.
| PE-HD oder HDPE | |
| PE-LLD oder LLDPE | |
| PE-LD oder LDPE | 
|
Die verschiedenen Kürzel, die hinter den Buchstaben PE stehen, beschreiben den wesentlichen Unterschied zwischen den drei Sorten, nämlich die unterschiedliche Dichte:
- PE-HD hat einen hohe Dichte (High Density) von durchschnittlich etwa 0,955 g/cm3
- PE-LD hat eine geringe Dichte (Low Density) von durchschnittlich etwa 0,925 g/cm3
- PE-LLD hat eine teilweise recht niedrige Dichte von 0,87–0,94 g/cm3, der Namen leitet sich von Linear Low Density ab, da trotz der wenig verzweigten Struktur eine niedrige Dichte hat.
Schauen wir uns zur Wiederholung nach einmal den Begriff der Dichte an:
- Wie ist die Dichte definiert?
- Vergleicht man die Dichte von Stoffen im gasförmigen bzw. festen Zustand, so hat man gasförmigen Zustand eine sehr viel geringere Dichte? Wie lässt sich das erklären?
- Wie kann man bei verschiedenen Feststoffen unterschiedliche Dichten erklären?
Hier hat man einen direkten Zusammenhang zwischen innerer Struktur und der von außen zu messenden Eigenschaft, hier der Dichte. Dichte gibt ja an, wieviel Masse auf ein bestimmtes Volumen kommt. Da wir hier die gleichen Arten an Atomen (nur C und H) und eigentlich den gleichen Aufbau haben, geht es letztendlich hier um die Anzahl der Atome, die sich in einem Raumbereich befinden. Und die hängt von dem inneren Aufbau ab. Man kann sich das so vorstellen, dass bei unverzweigten Ketten, wie beim PE-HD, diese Ketten sehr nah aneinander und parallel anlagern können, da nichts absteht. Damit liegen viele Atome näher beieinander und damit ist mehr Masse im gleichen Raumbereich vorhanden.
Beim PE-LD und PE-LLD ist der Abstand offensichtlich größer (also weniger Atome pro Raumbereich), was sich damit erklären lässt, dass die Seitenketten dazu führen, dass die Ketten ungeordnet neben- bzw. durcheinanderliegen.
Interessanterweise die Dichte bei PE-LLD teilweise sogar niedriger als bei dem PE-LD. Das passt ja irgendwie gar nicht zu dem Aufbau der Kohlenstoffkette und der Menge an Verzweigungen. Spekuliere darüber, wie man das erklären könnte!
Zusammenhang zwischen Struktur und Eigenschaften genauer betrachtet
Dichte
Wie auch die Dichte lassen sich weitere Eigenschaften der verschiedenen PE-Typen aufgrund des unterschiedlichen Molekülbaus erklären. Betrachten wir eine anderes andere Auswirkung, zu der wir bisher nur die Bezeichnung angesprochen haben. Dazu noch einmal kurz als Wiederholung:
Wie sich der unterschiedliche Molekülaufbau auf den Anteil an kristallinen Bereichen auswirkt kann man an der folgenden Tabelle auslesen. Dazu noch einmal die genauen Daten zur Dichte im Vergleich:
| Eigenschaft | PE-LD | PE-HD | PE-LLD |
|---|---|---|---|
| Dichte in g/cm3 | 0,915–0,935 | 0,94–0,97 | 0,87–0,94 |
| Kristallinität in % | 40–50 | 60–80 | 10–50 |
Kristalline Bereiche bedeuten ja, dass die Molekülketten parallel liegen und somit wenig Platz einnehmen und damit passen diese Daten gut zu der Dichte der verschiedenen Polyethylen-Typen.
Schmelz- und Siedetemperatur
Betrachten wir nun mal die Schmelz- und Siedetemperatur der verschiedenen PE-Typen. Es sind ja allgemein zwei Dinge, die im Wesentlichen bei der Siedetemperatur eine Rolle dabei spielen:
- Die Masse der Teilchen, die beim Erwärmen in Bewegung gebracht werden müssen.. Je größer die Masse der Teilchen ist, desto schwieriger ist es, sie in Bewegung zu bringen. Bei den Kunststoffen haben wir allgemein sehr große Moleküle (bis zu mehreren tausend C-Atomen lange Ketten!), so dass es hier vor allem darum geht, die Ketten in beim Schmelzen in Bewegung zu bringen. Diese langen Ketten führen auch dazu, dass die Kunststoffe meist fest sind.
- Die Anziehung der Moleküle untereinander, die überwunden werden muss. Damit sich die Moleküle bewegen können, müssen auch die Anzeihungskräfte der Moleküle/Molekülketten untereinander überwunden werden. Da wir bei PE reine Kohlenwasserstoffketten haben, haben wir keine polaren Gruppierungen und daher wirken nur die Van-der-Waals-Kräfte.
Die Molekular-Masse spielt nur dann eine Rolle, wenn sich die Anzahl der Atome in einer Polymer-Kette wesentlich unterschiedet. Bei festen Werkstoffen es weniger wichtig, denn die Unterschiede sind nicht so groß. Liegen die Ketten aber parallel (wie in den teilkristallinen Bereichen), so können die Van-der-Waals-Kräfte besser wirken. Die Van-der-Waals-Kräfte bezeichnet ja die Anziehung durch sich zufällig ergebende Dipole, die bei günstiger Lage an Nachbarmoleküle weitergegeben werden können (temporäre und induzierte Dipole), wodurch kurzfristig eine Anziehung besteht. Die Anziehung ist umso höher, je größer die Fläche ist und je paralleler die Moleküle liegen.
Wenn die Anziehung bei parallelen Ketten größer ist, sollte auch die Siedetemperatur mit höherer Kristallität größer sein. Hier dazu die Daten, die das belegen:
| Eigenschaft | PE-LD | PE-HD | PE-LLD |
|---|---|---|---|
| Kristallinität in % | 40–50 | 60–80 | 10–50 |
| Schmelzpunkt in °C | 130–145 | 130–145 | 45–125 |
| Wärmeformbeständigkeit bis °C | 80 | 100 | 30–90 |
Offensichtlich passt der Zusammenhang bei dem PE-LLD sehr gut, denn es hat die niedrigste Siedetemperatur bei dem geringsten Anteil an Kristallinität. Das PE-LD zeigt, ähnlich wie bei der Dichte, dass es da Auswirkungen durch die langen und auch verzweigten Seitenketten gibt, die die Anziehung wiederum verbessern, so dass wir bei PE-HD und PE-LD den gleichen Schmelzbereich haben.
Unterschiede gibt es bei der Wärmeformbeständigkeit, einer speziellen Messgröße zur Untersuchung von Kunststoffen.
Allerdings bleibt das PE-HD länger stabil und ist erst bei einer höheren Temperatur verformbar.
Härte und Reißfestigkeit
Das folgende Bild zeigt einen Überblick, wie Molekülmasse und Kristallinität sich auf die Eigenschaften der Polyethylene als Feststoff auswirken. Neben den der Schmelztemperatur gibt es da noch Unterschiede bezüglich der Festigkeit (hart, weich, spröde).
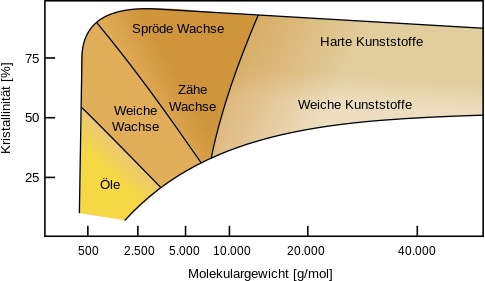
Die Darstellunng macht deutlich, dass man harte Kunststoffe nur bekommt, wenn es einen hohen Zusammenhalt zwischen verschiedenen Molekülketten gibt. Das kann entweder durch Kristalline Bereiche geschehen oder, was wir bisher nur theoretischen angesprochen haben, bei den Duroplasten, wo man echte Bindungen zwischen den Molekülketten haben muss.
Überlegen wir uns, ob der wir die verschiedenen Eigenschaften von den verschiedenen PE-Varianten erklären können.
Das Besondere an diesem Diagramm ist, dass wir hier nicht eine funktionelle Zuordnung haben, wie sonst bei Graphen. Man darf das Diagramm also nicht so verstehen, dass man fragt: Welche Kristallinität gehört zu welchem Molekulargewicht. Vielmehr ist jede Art von Kombination an Molekulargewichtung und Kristallinität möglich und das Diagramm zeigt an, welche nach außen sichtbaren Eigenschaften der entstandene Kunststoff dann hätte.
Tupperware macht Werbung für ihre besonders haltbaren und auch bei kalten Temperaturen nicht spröde werdenden Dosen. Bei Normaltemperatur sind die Dosen dagegen recht weich und geben beim Anfassen ein geradzu wachsartiges Gefühl. Welche Art von Polyethylen könnten die Entwicklungsingenieure für die Gefrierdosen verwendet haben?
- Gib an, wie die Molekularmasse und der Kristallisationsgrad sein müsste.
Versuche allgemein zu beschreiben, wie sich die Eigenschaften eines Polyethylens generell mit
- größer werdendem Molekulargewicht
- mit zunehmender Kristallinität
verändern. Betrachte dazu die Tendenz jeweils in einer Achsenrichtung getrennt von der anderen Achsenrichtung.
Um die Stabilität eines Kunststoffes zu verbessern, gibt es ein spezielles Verfahren, durch das man in dem Material den Anteil der kristallinen Bereiche erhöhen kann. Dies geschieht beim sogenannten Verstrecken. Es führt zu einer erhöhten Orientierung der Kettenmoleküle, sprich sie ordnen sich parallel zueinaner an, was die Entstehung von kristallinen Bereichen bedeutet und damit eine höhere Stabilität. Gerade bei Fasern, wird dieses Verfahren häufig genutzt.
Chemische Beständigkeit
Zwei Aspekte spielen bei der Chemikalienbeständigkeit eine Rolle:
- Wie reaktiv sind die Atome/Gruppierungen innerhalb des Makromoleküls.
- Wie dicht die nebeneinander liegende Makromoleküle zueinander liegen.
Da alle Polyethylen-Typen aus den gleichen Arten von Atomen bestehen, gibt es hier keinen Unterschied. Die Moleküle sind alle nach außen hin unpolar, wie es bei allen Alkanen ist, egal ob die Moleküle verzweigt sind oder linear.
Gäbe es funktionelle Gruppen oder andere Atome, so würde das zu Teilladungen führen, die eine Angriffsmöglichkeit für polare Lösungsmittel bieten würde. So sind alle Polyethylen-Arten beständig gegen schwache Säuren und Laugen und sie quellen Wasser nicht auf. Die Gas- und Wasserdampfdurchlässigkeit (von polaren Stoffen) ist niedriger als bei den meisten Kunststoffen. Unploare Gase wie Sauerstoff und Kohlendioxid diffundiert allerdings durch PE hindurch.
Schauen wir uns eine Vergleich der chemischen Beständigkeit bei den verschiedenen PE-Typen genauer in einer Tabelle an:
| Eigenschaft | PE-LD | PE-HD | PE-LLD |
|---|---|---|---|
| Chemische Beständigkeit | bedingt beständig | beständig, außer starke Oxidationsmittel | bedingt beständig |
| beständig gegen ... | Wasser, verdünnte Säuren, Laugen, Salzlösungen, Lösungsmittel, Alkohole, aliphatische Kohlenwasserstoffe, Benzin | Heißwasser, Mineralsäuren, Laugen, Lösungen anorganischer Salze, aliphatische Kohlenwasserstoffe, Alkohole, Ester, Ketone, Mineralöle, Amine, organische Säuren, Fette und Öle. | Wasser, verdünnte Säuren, Laugen, Salzlösungen, Lösungsmittel, Alkohole, aliphatische Kohlenwasserstoffe, Benzin |
| unbeständig gegen ... | starke Säuren und Oxidationsmittel, oxidierende Säuren, Ester, Ketone, aromatische und chlorierte Kohlenwasserstoffe | oxidierende Säuren, aromatische Kohlenwasserstoffe | starke Säuren und Oxidationsmittel, oxidierende Säuren, Ester, Ketone, aromatische und chlorierte Kohlenwasserstoffe |
Insgesamt kann man sagen, dass
Vervollständige den Multpile-Choice-Test zu chemischen Beständigkeit:
Einsatzmöglichkeiten für die verschiedenen PE-Typen
Die unterschiedlichen Eigenschaften der verscheidenen PE-Typen führt zu ganz verschiedenen Anwendungsgebieten.
Da PE-HD mit seinem höheren Anteil an kristallinen Bereichen wesentlich stabiler ist, wird es meist für Formteile verwendet. Dazu gehören Haushaltswaren, Lager- und Transportbehälter, Abfalltonnen, Flaschenkästen, Benzinkanister und Kraftfahrzeugtanks. Aber auch Seile können daraus hergestellt werden.
PE-LD und PE-LLD werden dagegen eher zu Folien für die Verpackaung oder als Beschichtung für andere Materialien verwendet: Schwersack-Folien, Schrumpffolien, Tragetaschen, Landwirtschaftsfolien, Wasserdampfsperren bei Verbundmaterialien, Ummantelungen von Fernmeldekabeln, Beschichtung von Stahlrohren, flexible Behälter und Flaschen.
In der Verarbeitung unterscheiden sich die alle PE-Typen nur unwesentlichen. Als Thermoplast kann PE in verflüssigter Form in Formen gegossen und in aufgeblasen werden. Unterschiedlich ist nur die Verarbeitungstemperatur. Einen Einfluss auf die Kristallinität hat aber auch die Geschwindigkeit, mit der das Material abgekühlt wird. Schnell abgekühlte Formteile weisen eine geringe Kristallinität auf, da die Moleküle keine Zeit hatten sich parallel anzuordnen.
Recycling von Polyethylen
Ähnlich wie bei anderen Kunststoffe geht man davon aus, dass auch Polyethylen sich erst nach bis zu 450 Jahre von alleine zersetzt (→ andere Müllarten zum Vergleich). Seine chemische und biologische "Stabilität", was Kunststoffe als Werkstoffe so praktisch machen, führen aktuell zu immer mehr Umweltverschumtzung.
Da es sich bei Polyethylen um einen Thermoplasten handelt ist es theoretisch recht gut wiederzu verwerten, denn man kann es theoretisch einfach umschmelzen zu einem neuen Produkt. In Deutschland gibt es ein recht gut ausgebautes Recycling-System, das im Wesentlichen aus dem Rücknahme-System "Grüner Punkt" entstanden ist.
2013 fielen in Deutschland 5,68 Millionen Tonnen Kunststoffabfälle an. Der überwiegende Teil sind Produktabfälle, die beim privaten Endverbraucher oder im Gewerbe anfallen: etwa 4,75 Millionen Tonnen. Der Rest sind Produktions- und Verarbeitungsabfälle: 0,93 Millionen Tonnen. Die meisten Kunststoffabfälle stammen aus dem Verpackungsbereich: 1,4 Millionen Tonnen. <\br> ...<\br>
Die anfallenden Kunststoffe werden nahezu vollständig verwertet (in 2013 zu 99 Prozent).
Während man in Deutschland also einigermaßen auf das Recycling achtet, ist das gerade in vielen Entwicklungsländern ein eklatantes Problem. Gerade im Meer sammeln sich in einigen Gegenden aufgrund besonderer Strömungen Unmengen an Müll, der durch die mechanische Bearbeitung von Wind und Wellen zu Mikroplastik-Teilch zerfallen.
Die Bedeutung von Plastik-Müll im Meer wurde anfangs erst einmal verharmlost. In den 1980er Jahren gingen Wissenschaftler noch davon aus, dass die Plastikteilchen nicht weiter gefährlich für die Umwelt seien, da sie von Algen und Kleinstlebewesen besiedelt wurden.
2012 berichtete das wissenschaftliche Fachjournal Environmental Science & Technology aber über eine Untersuchung an vielen Stränden auf allen sechs Kontinenten, die überall Mikroplastikteilchen nachwies; dazu gehören wohl auch Fasern aus Fleece- und anderen Kleidungsstücken aus synthetischen Materialien: Beim Waschen in der Waschmaschine enstehen bis zu 1900 kleinste Kunststoffteilchen pro Waschgang, die durch die Bewegung in der Waschtrommel abbrechen.
Trotz ihrer geringen Größe sind Mikropartikel vermutlich das größte Problem, denn über Meeres-Tiere, die sich normalerweise von Kleinstlebewesen ernähren, können sie auch in Lebensmittel gelangen und damit womöglich auf unseren Tisch. Problematisch sind sie auch deshalb, weil sie im Gegensatz zu größeren Gegenständen nicht so einfach aus dem Meer gefischt werden können.
Einige Länder Afrikas haben Ende2017/Anfang 2018 strenge Gesetze zur Vermeidung der Flut an Plastik-Müll und seinen verheerenden Umweltfolgen erlassen. In Kenia drohen Herstellern, Verkäufern und sogar Benutzern von Plastiktüten Haftstrafen von bis zu vier Jahren oder Geldbußen von 40.000 Dollar, umgerechnet etwa 32.000 Euro.
- Informiere dich über die aktuelle Situation in Kenia, wie die Regierung das Gesetz durchetzen will und welche Chancen ein solches Verbot bietet.
Warum ein echtes Recycling sich immer noch nicht wirklich lohnt, wird in diesem Artikel vom WDR erläutert: Kunststoff-Recycling noch zu teuer.
- Fasse die Informationen des Textes zusammen.
Abschluss
Obwohl wir uns hier nur mit einer Art Kunststoff beschäftigt haben, zeigt sich schon hier, das durch die Wahl eines Produktionsverfahren, Produktionsbedingungen, Katalysatoren usw. gezielt Polymere mit erwünschten Eigenschaften hergestellt werden können. Und neben harten oder weichen Kunststoffen sind auch Wachse, Fette und sogar Öle aus Polyethylen herstellbar.
Was wir beim Polyethylen schon erkannt haben, werden wir auch bei den folgenden Kunststoffe anwenden ... und noch ein wenig mehr kennenzulernen.
Polypropylen (PP)
Synthese von Polypropylen
Zu Beginn noch einmal die Wiederholung der grundlegenden Begriffe:
Polypropylen PP ist neben dem am häufigsten verwendeten Poylethylen der am zweithäufigsten verwendete Standardkunststoff und wird häufig in Verpackungen verwendet. Hier einige Beispiele für die Nutzung von PP
Im Gegensatz zum Polyethylen, haben wir beim Polypropylen eine Seitenkette. Selbst wenn die Monomere sich immer auf die gleiche Art und Weise anordnen, kann die räumliche Anordnung der Methylgruppe unterschiedlich sein. Dabei unterscheidet man zwischen drei Varianten .
Die zwei Bilder zeigen die Polypropylen-Kette einmal von der Seite und einmal von oben!
- Überlege bei den verschiedenen Polypropylenarten, wie sich die Taktizität auf die Kristallinität auswirkt!
- Wie wirkt sich wiederrum die Kristallinität auf weitere Eigenschaften wie die Schmelztemperatur aus?
Vergleich der Eigenschaften von PE und PP
- Polypropylen ähnelt in vielen Eigenschaften Polyethylen, speziell im Lösungsverhalten und den elektrischen Eigenschaften.
- Die zusätzlich vorhandene Methylgruppe verbessert die mechanischen Eigenschaften und die thermische Beständigkeit, während die chemische Beständigkeit durch sie sinkt.
- Durch das tertiäre Kohlenstoffatom ist PP chemisch weniger beständig als PE.
- PP ist geruchlos und hautverträglich, für Anwendungen im Lebensmittelbereich und der Pharmazie ist es geeignet, es ist physiologisch unbedenklich und biologisch inert.
- PP kann mit mineralischen Füllstoffen wie z. B. Talkum, Kreide oder Glasfasern gefüllt werden. Dadurch wird das Spektrum der mechanischen Eigenschaften (Steifigkeit, Gebrauchstemperaturen, etc.) deutlich erweitert.
Transparenz von PP
Polyvinylchlorid (PVC)
Polystyrol (PS)
Besser bekannt in geschäumtem Zustand als Styropor® (Handelsname der BASF)
Polytetrafluorethylen (PTFE)
Sein Handelsname ist Teflon® (E. l. Du Pont de Nemours and Company) oder Tefal®
Polymethylmethacrylat (PMMA)
Unter dem Handelsnamen Plexiglas® (Evonik Industries AG) verkauft.
Polyacrylnitril (PAN)
, als Copolymer mit Polymethylmethacrylat zur Herstellung von Textilfasern