Programmieraufgabe und Chemie-Lexikon/Elektronegativität und Polarität: Unterschied zwischen den Seiten
main>Karl Kirst (Darstellung überarbeitet) |
KKeine Bearbeitungszusammenfassung Markierung: 2017-Quelltext-Bearbeitung |
||
| Zeile 1: | Zeile 1: | ||
Bevor wir uns mit dem Thema Elektronegativität beschäftigen, müssen wir noch einmal zurückblicken, zum Thema "Atombindung". Atome halten ja in Atombindungen zusammen, da die Atomkerne Elektronenpaare gemeinsam nutzen und diese von beiden Atomkernen angezogen werden. Dadurch erreichen die Atome den Edelgaszustand, was das Ziel nahezu aller Reaktionen ist. | |||
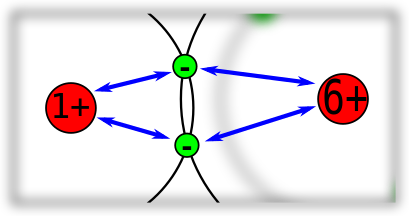
Allerdings ist die Anziehung der Bindungselektronen von den Protonen im Kern abhängig und damit ist klar, dass die Anzahl der Protonen bestimmt, wie stark die Anziehung der Bindungselektronen ist. Drei einfache Beispiele: | |||
{{2Spalten| | |||
[[File:Atombindung-C-C-mit-Schalen.svg]] | |||
| | |||
Bei der Bindung zwischen zwei Kohlenstoff-Atomen sind es zwei gleiche Atomkerne, die an den gemeinsamen Bindungselektronen ziehen. Die Bindungselektronen sind hier genau in der Mitte. | |||
}} | |||
{{2Spalten| | |||
[[File:C-H-Bindung-fuer-Elektronegativitaet.svg]] | |||
| | |||
Bei der Bindung zwischen einem Wasserstoff- und einem Kohlenstoff-Atom unterscheidet sich die Anziehung auf die Bindungselektronen. Denn das Kohlenstoff-Atom hat mehr Protonen im Kern. Daher ist die Anziehung durch das Kohlenstoff-Atom stärker. Allerdings sind die Bindungselektronen etwas weiter vom Kern des Kohlenstoff-Atoms entfernt, da die Bindungselektronen auf der zweiten Schale sind. Das verringert wiederum die Anziehung etwas. | |||
}} | |||
{{2Spalten| | |||
[[File:O-H-Bindung-fuer-Elektronegativitaet.svg]] | |||
| | |||
Bei dieser Bindung zwischen einem Wasserstoff- und einem Sauerstoff-Atom ist der Unterschied noch größer als vorher beim Wasserstoff im Vergleich zum Kohlenstoff. Es ist daher zu erwarten, dass die Bindungselektronen zwischen Wasserstoff- und Sauerstoff-Atom mehr zum Sauerstoff hingezogen werden. Kohlenstoff- und Sauerstoff-Atom haben gleich viele Schalen, Sauerstoff aber mehr Protonen im Kern. | |||
}} | |||
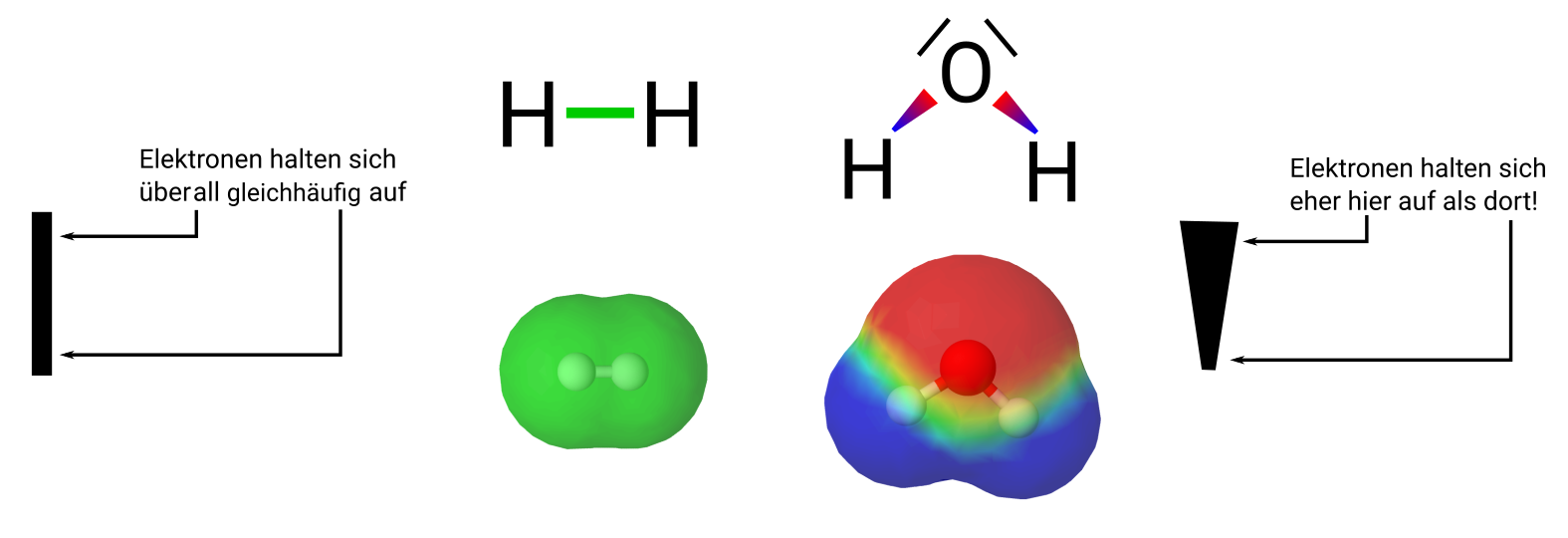
Wie kann man das verstehen, dass die Elektronen mehr zum Sauerstoff-Atom hingezogen werden als zum Wasserstoff-Atom? Es ist nicht ganz so einfach zu, denn man muss daran denken, dass die Elektronen nicht - wie im Bild zu sehen ist - sich an einer festen Stelle aufhalten. Sie müssen in Bewegung sein, denn sonst würden sie zum Atomkern hingezogen werden. Man kann sich die "Position" eines Elektrons eher als Aufenthaltswahrscheinlichkeit vorstellen. | |||
=== | <center><iframe src="https://player.vimeo.com/video/351900334" width="640" height="623" frameborder="0" allow="autoplay; fullscreen" allowfullscreen></iframe></center> | ||
Das Video zeigt eine Simulation, mit der mit Hilfe der hellblauen Fläche die Aufenthaltswahrscheinlichkeit der Elektronen dargestellt wird. Die Contour-Linien (die wie Höhenlinien auf einer Landkarte aussehen) zeigen die Bereiche mit gleicher Wahrscheinlichkeit. | |||
Zu Beginn der Simulation sind die Atome noch nicht miteinander verbunden. Nach dem Start bildet sich die Bindung aus und die blaue Fläche konzentriert sich zwischen den beiden Atomkernen ''(die Kreuzchen bei A und B)''. | |||
Die Änderung der Anziehung durch den Schieberegler bewirkt die Verschiebung der Wolke und damit der Aufenthaltswahrscheinlichkeit der Elektronen. Je stärker der Unterschied in der Anziehung ist, desto größer ist die Wahrscheinlichkeit das sich die Elektronen beim Atom mit der stärkeren Anziehung aufhalten. | |||
Die folgende Simulation, die du auch selber bedienen kannst, zeigt bewegte Elektronen, wenn du die Einstellung ''"Electron distribution view"'' auswählst. Zusätzlich wird die rote "Wolke verändert", wenn man verschiedene Atome ausgewählt hat. Auch wenn die Elektronen sich zu schnell bewegen, um sie genau verfolgen zu können, erkennt man doch, dass sie sich - je nach ausgewähltem Atom - mehr oder weniger bei dem einen oder anderen Atom aufhalten. | |||
<center><iframe scrolling="no" allowfullscreen="true" webkitallowfullscreen="true" mozallowfullscreen="true" src="https://lab.concord.org/embeddable.html#interactives/interactions/polarization.json" nuan_newframe="true" style="font-size: 0.9375rem;" width="618px" height="418px" frameborder="no"></iframe></center> | |||
# | |||
Die Bindungselektronen, die mehr oder weniger zu einem der Atome hingezogen werden, deutet man in der Lewisschreibweise dadurch an, dass man statt eines Striches für die Bindungselektronen einen Keil malt. | |||
<center>[[File:Darstellung polarer Bindungen.svg]]</center> | |||
== Elektronegativität == | |||
Wir haben bisher nur erwähnt das unterschiedliche Atome die Bindungselektronen unterschiedlich stark anziehen. Diese Anziehung hängt von zwei Faktoren ab: | |||
# Wieviele Protonen hat der Atomkern? ''(je mehr desto stärker die Anziehung)'' | |||
# Wie groß ist das Atom, also wieviele Schalen hat es? ''(denn je näher am Kern desto stärker die Anziehung)'' | |||
Man kann zwar anhand der Informationen des Periodensystem genau sagen, wieviele Protonen der Atomkern hat und wieviele Schalen, aber wie stark sich das jeweils auswirkt, lässt sich nicht so einfach abschätzen. Das Diagramm mit den Atomradien zeigt außerdem, dass der Atomradius sich innerhalb einer Periode verändert, da die größere Protonenanzahl die Elektronen stärker anzieht. | |||
<center></center> | |||
Glücklicherweise wurde uns diese Einschätzung abgenommen und in Form einer Zahl quantifiziert, die genau angibt, wie stark die Anziehung auf die Bindungselektronen ist. | |||
Version vom 7. November 2019, 10:27 Uhr
Bevor wir uns mit dem Thema Elektronegativität beschäftigen, müssen wir noch einmal zurückblicken, zum Thema "Atombindung". Atome halten ja in Atombindungen zusammen, da die Atomkerne Elektronenpaare gemeinsam nutzen und diese von beiden Atomkernen angezogen werden. Dadurch erreichen die Atome den Edelgaszustand, was das Ziel nahezu aller Reaktionen ist.
Allerdings ist die Anziehung der Bindungselektronen von den Protonen im Kern abhängig und damit ist klar, dass die Anzahl der Protonen bestimmt, wie stark die Anziehung der Bindungselektronen ist. Drei einfache Beispiele:
Bei der Bindung zwischen zwei Kohlenstoff-Atomen sind es zwei gleiche Atomkerne, die an den gemeinsamen Bindungselektronen ziehen. Die Bindungselektronen sind hier genau in der Mitte.
Bei der Bindung zwischen einem Wasserstoff- und einem Kohlenstoff-Atom unterscheidet sich die Anziehung auf die Bindungselektronen. Denn das Kohlenstoff-Atom hat mehr Protonen im Kern. Daher ist die Anziehung durch das Kohlenstoff-Atom stärker. Allerdings sind die Bindungselektronen etwas weiter vom Kern des Kohlenstoff-Atoms entfernt, da die Bindungselektronen auf der zweiten Schale sind. Das verringert wiederum die Anziehung etwas.
Bei dieser Bindung zwischen einem Wasserstoff- und einem Sauerstoff-Atom ist der Unterschied noch größer als vorher beim Wasserstoff im Vergleich zum Kohlenstoff. Es ist daher zu erwarten, dass die Bindungselektronen zwischen Wasserstoff- und Sauerstoff-Atom mehr zum Sauerstoff hingezogen werden. Kohlenstoff- und Sauerstoff-Atom haben gleich viele Schalen, Sauerstoff aber mehr Protonen im Kern.
Wie kann man das verstehen, dass die Elektronen mehr zum Sauerstoff-Atom hingezogen werden als zum Wasserstoff-Atom? Es ist nicht ganz so einfach zu, denn man muss daran denken, dass die Elektronen nicht - wie im Bild zu sehen ist - sich an einer festen Stelle aufhalten. Sie müssen in Bewegung sein, denn sonst würden sie zum Atomkern hingezogen werden. Man kann sich die "Position" eines Elektrons eher als Aufenthaltswahrscheinlichkeit vorstellen.
Das Video zeigt eine Simulation, mit der mit Hilfe der hellblauen Fläche die Aufenthaltswahrscheinlichkeit der Elektronen dargestellt wird. Die Contour-Linien (die wie Höhenlinien auf einer Landkarte aussehen) zeigen die Bereiche mit gleicher Wahrscheinlichkeit.
Zu Beginn der Simulation sind die Atome noch nicht miteinander verbunden. Nach dem Start bildet sich die Bindung aus und die blaue Fläche konzentriert sich zwischen den beiden Atomkernen (die Kreuzchen bei A und B).
Die Änderung der Anziehung durch den Schieberegler bewirkt die Verschiebung der Wolke und damit der Aufenthaltswahrscheinlichkeit der Elektronen. Je stärker der Unterschied in der Anziehung ist, desto größer ist die Wahrscheinlichkeit das sich die Elektronen beim Atom mit der stärkeren Anziehung aufhalten.
Die folgende Simulation, die du auch selber bedienen kannst, zeigt bewegte Elektronen, wenn du die Einstellung "Electron distribution view" auswählst. Zusätzlich wird die rote "Wolke verändert", wenn man verschiedene Atome ausgewählt hat. Auch wenn die Elektronen sich zu schnell bewegen, um sie genau verfolgen zu können, erkennt man doch, dass sie sich - je nach ausgewähltem Atom - mehr oder weniger bei dem einen oder anderen Atom aufhalten.
Die Bindungselektronen, die mehr oder weniger zu einem der Atome hingezogen werden, deutet man in der Lewisschreibweise dadurch an, dass man statt eines Striches für die Bindungselektronen einen Keil malt.
Elektronegativität
Wir haben bisher nur erwähnt das unterschiedliche Atome die Bindungselektronen unterschiedlich stark anziehen. Diese Anziehung hängt von zwei Faktoren ab:
- Wieviele Protonen hat der Atomkern? (je mehr desto stärker die Anziehung)
- Wie groß ist das Atom, also wieviele Schalen hat es? (denn je näher am Kern desto stärker die Anziehung)
Man kann zwar anhand der Informationen des Periodensystem genau sagen, wieviele Protonen der Atomkern hat und wieviele Schalen, aber wie stark sich das jeweils auswirkt, lässt sich nicht so einfach abschätzen. Das Diagramm mit den Atomradien zeigt außerdem, dass der Atomradius sich innerhalb einer Periode verändert, da die größere Protonenanzahl die Elektronen stärker anzieht.
Glücklicherweise wurde uns diese Einschätzung abgenommen und in Form einer Zahl quantifiziert, die genau angibt, wie stark die Anziehung auf die Bindungselektronen ist.